Perioperatives Schmerzkonzept
- Dosierung Paracetamol neu in der Regel 4x 500mg/d per os anstatt 4x 1gr/d
- Im Schema über die perioperative Basisanalgesie wurde bei der Verordnung/Verabreichung von Metamizol eine wichtige Ergänzung eingefügt: Bei transplantierten Patienten mit einer medikamentösen Immunsuppression soll Metamizol restriktiv verordnet und verabreicht werden, da Plasmaspiegel der Immunsuppressiva relevant gesenkt werden. Im Zweifelsfall soll diesbezüglich speziell bei Patienten nach Nierentransplantation offensiv Kontakt aufgenommen werden mit den Kaderärzten der Nephrologie
Einleitung
- Das Schmerzerleben ist die ureigenste Angelegenheit eines jeden Menschen, es beinhaltet immer einen grossen, subjektiven Anteil
- Daher sind Schmerzen für den Betroffenen immer individuell und nur er kann Aussagen über die Intensität dieses Schmerzes machen
Weiter wird Schmerz gemäss internationalem Konsens wie folgt beschrieben
- Die nachfolgenden Ausführungen zeigen die Empfehlungen einer einheitlichen, postoperativen Schmerztherapie fest
- Sie wurden in Zusammenarbeit mit der Klink für Anästhesiologie, Rettungsmedizin und Schmerztherapie, dem Zentrum für Intensivmedizin, dem Departement Chirurgie und dem Pflegedienst neu überarbeitet
- Die Empfehlungen gelten als Richtlinien und sind demzufolge verbindlich anzuwenden
Schmerzerfassung
Die Schmerzerfassung soll als bewusste Massnahme und nicht beiläufig erfolgen. Zum Basisassessment von Schmerzen sollen immer die Lokalisation, Intensität und die Qualität (stechend, reissend, brennend, stumpf, pochend, kolikartig) erfasst und dokumentiert werden. Zudem ist die Frage nach allfälligen Begleiterscheinungen (z.B. Übelkeit, Atemnot) sinnvoll.
- Die individuelle Schmerzstärke kann nur vom Patient selber angegeben werden
- Die regelmässige Schmerzerfassung durch eine normierte Skala (z.B. VAS = visual analog scale oder NRS = numeric rating scale) ist Voraussetzung für eine optimale Schmerztherapie
- Bei allen Skalen bedeutet 0 die geringste, 10 die stärkste Schmerzintensität
- Die Schmerzerfassung wird durch das Pflegepersonal durchgeführt und entsprechend dokumentiert
- In der unmittelbar postoperativen Phase 1-2 stündlich
- Ab dem ersten postoperativen Tag und soweit problemlosem Verlauf, in der Regel einmal pro Schicht
- Bei einem Wert grösser NRS 3/10 sollte immer eine Massnahme und ein anschliessendes Re-Assessment erfolgen.
| Skalawert 1-10 | Was kann ich tun? | Wann kontrolliere ich die Wirkung |
|---|---|---|
| < 3 |
|
1x pro Schicht |
| > 3 |
|
Nach Einnahme des Medikaments, Kontrolle innerhalb der Schicht (nach ca. 1 Stunde) |
| > 5 |
|
Wenn Schmerzen 30 min nach Medikamentengabe immer noch > 5 Stationsarzt / Pain-Dienst involvieren |
- Die Information des Patienten bezüglich der Schmerzbehandlung ist wichtig
- Der Patient muss wissen, dass es nicht normal und nicht nützlich ist, nach einer Operation an starken Schmerzen leiden zu müssen
- Weiter ist es ebenfalls nicht ratsam, erst nach einem Schmerzmittel zu verlangen, wenn die Schmerzen bereits sehr stark sind
Hilfsmittel für die Schmerzerfassung/Schmerzskalen
- Die Selbsteinschätzung des eigenen Schmerzniveaus bereitet vielen Patienten erhebliche Mühe, gilt aber nach wie vor als Goldstandard in der Schmerzerfassung.
- Nicht selten gelingt es nur schwer, sich nicht mit anderen, an Schmerzen leidenden Mitpatienten zu vergleichen und nur sein eigenes Empfinden zu klassifizieren
- Weiter machen sprachliche Barrieren eine genaue Erfassung der Schmerzen schwierig
- Zur Schmerzerfassung wurden diverse, einfach verständliche Skalen entwickelt, die mittlerweile weltweit sowohl bei Kindern aber auch Erwachsenen eingesetzt werden
- Sehr einfach zu verstehen ist die VAS (Visual analoge Scale) sowie die NRS (numeric analog scale) deren Einsatz zur Schmerzerfassung im Aufwachraum wie auch auf den Stationen grosszügig eingesetzt werden sollten
- Bei Patient-/innen, die keine Selbsteinschätzung vornehmen können (Alter, Demenz, kognitive Beeinträchtigung, Intubation), werden Beobachtungsinstrumente zur Schmerzeinschätzung angewendet. Nachfolgend werden die im LUKiS hinterlegten und am LUKS angewendeten Instrumente näher beschrieben.
Erwachsene:

- Die Numerische Rating Skala (NRS) gilt als zuverlässigstes Instrument zur Erfassung der Schmerzstärke. Die Patienten werden gebeten anzugeben, wie stark ihre Schmerzen auf einer durchnummerierten Skala mit den Polen 0 (kein Schmerz) bis 10 (grösster vorstellbarer Schmerz) sind.
- Verbale Rating Skala (VRS) beschreibt sechs Schmerzstärken in Worten, aus denen die Patient/-in den zutreffenden Begriff auswählt. Die Differenzierung ist unpräziser
-
Die Visuelle Anlalogskala (VAS) ist die visuelle Darstellung der Schmerzintensität. Anhand des Abstands von Null (keine Schmerzen) zur aktuellen Schmerzeinschätzung wird die Schmerzintensität eingeschätzt.
Ab einem Wert von ≥3 auf der Skala werden grundsätzlich Interventionen (medikamentös und oder nicht-medikamentös) zur Schmerztherapie eingeleitet. Die Ausnahme ist, wenn Patient/-innen explizit keine Intervention wünschen (zum Beispiel aufgrund Schmerzbiographie, chronischen Schmerzen).
Kinder:
-
 oder Traurigsein verwechselt werden (Bächle, 2013).
oder Traurigsein verwechselt werden (Bächle, 2013).
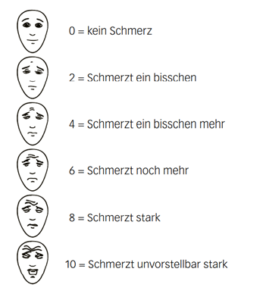
- Gesichterskala nach Hicks
- Die Gesichterskala nach Hicks ist eine Selbsteinschätzungsskala, die bei Kinder
- n ab 4 Jahren einsetzbar ist. Der Cut-off – Punkt für eine Intervention zur Schmerztherapie liegt bei 4 (Hicks, 2001).
- Anwendung: Die Skala wird dem Kind vorgelegt. Die darauf abgebildeten Gesichter helfen ihm mitzuteilen, wie stark die Schmerzen gerade sind. Die Kinder sollen dabei altersgerecht instruiert werden.
- Begriffe wie «glücklich» oder «traurig» sind zu vermeiden. Die klassischen Smiley-Skalen haben oft den Nachteil, dass sie mit UnglücklichseinInstrumente zur Fremdeinschätzung
Wenn immer möglich soll eine Selbsteinschätzung durch die Patient-/in erfolgen. Hierzu gibt es verschiedene Instrumente, die sich an unterschiedliche Zielgruppen (Neugeborene, Demente etc.) richten. Dabei werden Beobachtungskategorien im Rahmen einer Fremdeinschätzung evaluiert. Für die meisten Tests gilt, dass für definierte Kriterien Punkte vergeben werden und deren Summe eine Interpretation zulässt. Die erreichte Punktzahl darf nicht mit dem NRS gleichgesetzt werden.
Patient-/innen mit Demenz:
BESD:
- Grundsätzlich soll auch bei Menschen mit Demenz eine Selbsteinschätzung von Schmerzen vorgenommen werden.
- Zur Fremdeinschätzung kann das Instrument BEurteilung von Schmerzen bei Demenz (BESD) (Basler et al., 2006) angewendet werden. Die Beobachtung soll möglichst bei gleichen Situationen (z.B. bei der Körperpflege, Sitzen, Mobilisation) erfolgen. Die Maximale Punktzahl beträgt 10. Ab mehr als einem Punkt soll der Schmerz thematisiert werden und ab 2 Punkten soll eine Analgesie eingeleitet werden. Schmerzen sind ausserdem wahrscheinlich, wenn
- bei einer Aktivität der BESD höher eingeschätzt wurde als in einer Ruhesituation.
- eine Schmerzbehandlung zu einer Reduktion des Verhaltens nach BESD führt (Behandlungsversuch).
|
Atmung |
Punkte |
|
Normal |
0 |
|
Gelegentlich angestrengte Atmung, kurze Phasen von Hyperventilation |
1 |
|
Lautstarkes angestrengtes atmen, lange Phasen von Hyperventilation |
2 |
|
Negative Lautäusserung |
|
|
Keine |
0 |
|
Gelegentliches Stöhnen oder Ächzen, leise negative oder missbilligende Äusserungen |
1 |
|
Wiederholt beunruhigtes Rufen, lautes Stöhnen oder Ächzen, weinen |
2 |
|
Gesichtsausdruck |
|
|
Lächelnd, nichtssagend |
0 |
|
Traurig, ängstlich, sorgenvoller Blick |
1 |
|
grimassierend |
2 |
|
Körpersprache |
|
|
Entspannt |
0 |
|
Angespannt, nervös, hin und her gehend, nestelnd |
1 |
|
Starr, geballte Faust, angezogene Knie, sich entziehen oder wegstossen, um sich schlagend |
2 |
|
Trost |
|
|
Trösten nicht notwendig |
0 |
|
Ablenken oder beruhigen durch Stimme oder Berührung möglich |
1 |
|
Trösten, ablenken, beruhigen nicht möglich |
2 |
Die Ausführliche Beschreibung zum BESD ist im Anhang aufgeführt (Basler, 2006).
Patient-/innen, die sich nicht äussern können:
ZOPA: Das Zurich Observation Pain Assessment (ZOPA®) ist ein spezifisches Schmerzassessment bei Patienten mit kognitiven und/oder Bewusstseinsbeeinträchtigungen. Es werden 13 Verhaltensmerkmale in vier Kategorien (Lautäusserung, Gesichtsausdruck, Körpersprache und physiologische Indikatoren) beobachtet. Eine Aussage über die Schmerzintensität ist nicht möglich, es werden lediglich Anzeichen für Schmerz erfasst. Es wird geprüft, ob Verhaltensmerkmale vorhanden sind oder nicht. Schmerzlindernde Interventionen sollten ab dem Auftreten eines Merkmals eingeleitet und evaluiert werden (Maier et al, 2015)
|
Verhaltensmerkmale |
Definitionen |
|
Lautäusserungen Klagen/Stöhnen Brummen |
Leise bis laute wortlose Geräusche oder immer wiederkehrende verbale, leidende Äusserungen Vor sich hinmurmeln in eher dumpfer Lautlage (Lippen eher geschlossen) |
|
Gesichtsausdruck Verzerrter, gequälter Gesichtsausdruck Starrer Blick Zähne zusammenpressen (Tubus beissen) Augen zusammenkneifen Tränenfluss
|
Beinhaltet Stirne runzeln und/oder Augenbrauen hochziehen Ausdrucksloser, leerer Blick und/oder längere Fixierung auf einen Punkt Zähne werden fest aufeinander gedrückt (auch bei oral intubierten Menschen) Augen fest zudrücken Tränen in den Augen und/oder Tränen aus den Augen fließend |
|
Körpersprache Ruhelosigkeit Massieren oder Berühren eines Körperteils Angespannte Muskeln |
Häufiges hin und her Bewegen innerhalb oder ausserhalb des Bettes Gezieltes Anfassen und/oder Reiben eines Körperteils Muskeln sind angespannt und unbeweglich, evtl. unbeugsame starre Körperstellung |
|
Physiologische Indikatoren Blutdruck / Puls Atmung |
Blutdruck oder Puls verändern sich gegenüber Ausgangswert Änderung in der regulären Atemfrequenz, z.B. nach Luft schnappen oder anstrengende, ermüdende Atemzüge, erhöhte Atemfrequenz |
|
Veränderung Gesichtsfarbe Schwitzen / Röte |
Vermehrtes Absondern von Schweiss aus nicht direkt erklärbaren Gründen, wie z.B. erhöhte Körper- oder Aussentemperatur, auch mit fleckenhafter oder das ganze Gesicht bedeckender Röte, bleibend oder wechselnd |
Fremdeinschätzung in der Intensivpflege: CPOT
Bei intubierten und beatmeten Patient-/innen wird als Beobachtungsinstrument das Critical Pain Observation Tool (CPOT) (Gélinas et al., 2014) angewendet: Die Patient-/innen werden in einem ersten Schritt für eine Minute in Ruhe beobachtet, um einen Ausganswert zu erhalten, Danach wird die Muskelspannung durch passives Beugen und Strecken der oberen Extremität beurteilt, In einem zweiten Schritt erfolgt die Erfassung des CPOT während einer potenziell schmerzhaften Prozedur (z.B. Positionswechsel), um allfällige Veränderungen in seinem Verhalten bei Schmerz zu entdecken.
Bewertung des CPOT: 0= vermutlich keine Schmerzen, 8= vermutlich starke Schmerzen. Der numerische Wert darf nicht mit der NRS-Skala verglichen werden. Interventionen sind ab einem Wert von 3 bis 4 vorzunehmen.
|
Indikator |
Bewertung |
Beschreibung |
|
|
|
Gesichtsausdruck |
Entspannt, neutral |
0 |
·Keine Muskelanspannung beobachtbar |
|
|
|
Angespannt |
1 |
·Runzelt Stirn ·Zieht Augenbrauen zusammen ·Kneift Augen etwas zu ·Verzieht das Gesicht oder zeigt weitere Veränderungen des Gesichtsausdrucks (z.B. öffnet Augen, Tränenfluss während schmerzhaften Prozeduren) |
|
|
|
Verziehen des Gesichts |
2 |
·Zeigt alle oben genannten Veränderungen des Gesichtsausdrucks und zusätzlich festes Zusammenkneifen der Augen (eventuell öffnet Patient dabei den Mund oder beisst auf den Tubus) |
|
|
Körperbewegungen |
Keine Bewegungen, keine auffällige Körperhaltung beobachtbar |
0 |
·Bewegt sich überhaupt nicht (bedeutet aber nicht unbedingt Schmerzfreiheit) oder hat eine normale Körperhaltung (keine Bewegungen hin zur schmerzhaften Körperstelle oder um eine Schonhaltung einzunehmen) |
|
|
|
Schutzverhalten, Schonhaltung |
1 |
·Zeigt langsame vorsichtige Bewegungen ·Berührt, reicht schmerzhafte Stelle, erweckt Aufmerksamkeit durch Bewegungen |
|
|
|
Unruhig, agitiert |
2 |
·Zieht an Schläuchen ·Versucht aufzusitzen ·Bewegt Extremitäten ·Wälzt sich herum ·Befolgt keine Aufforderungen ·Wehrt sich gegen das Personal ·Versucht, aus dem Bett zu steigen |
|
|
Adaption an die Beatmung (intubierte Patient/-innen) |
Toleriert Beatmung auch während Positionswechsel |
0 |
·Keine Alarme ·Beatmung problemlos |
|
|
|
Hustet, toleriert aber Beatmung |
1 |
·Hustet ·Alarme möglich, sie stoppen aber spontan |
|
|
|
Kämpft gegen die Beatmung |
2 |
·Asynchrone Beatmung ·Presst gegen die Beatmung, häufige Alarme |
|
|
Lautäusserungen (nicht intubierte Patient/-innen) |
Normaler Tonfall oder keine Äusserung |
0 |
·Spricht in normalem Tonfall oder ist still |
|
|
|
Seufzen, stöhnen |
1 |
·Seufzt ·stöhnt |
|
|
|
Schreien, Weinen, Schluchzen |
2 |
·Schreit ·Weint ·schluchzt |
|
|
Muskelspannung (Beurteilung durch passives Beugen und Strecken der oberen Extremität während Ruhephase oder bei Positionswechsel) |
Entspannt |
0 |
·Zeigt keinen Widerstand bei passiver Bewegung |
|
|
|
Angespannt, steif |
1 |
·Zeigt Widerstand bei passiver Bewegung |
|
|
|
Sehr angespannt, starr |
2 |
·Zeigt starken Widerstand gegen passive Bewegung oder passive Bewegung ist nicht durchführbar |
|
Kinder:
KUSS: Die Kindliche Unbehagen- und Schmerzskala nach Büttner (KUSS) dient der postoperativen Schmerzmessung bei Säuglingen und Kindern bis zur Vollendung des vierten Lebensjahres. Sie eignet sich auch für Kinder, die älter sind und sich nicht äussern können. Für jede Variable ist nur eine Aussage zulässig. Die Dauer der Beobachtung beträgt 15 Sekunden. Es können maximal 10 Punkte erreicht werden. Ab vier Punkten muss eine Schmerztherapie eingeleitet werden. Mit steigender Punktzahl nimmt die Dringlichkeit zu (Büttner, 2000).
|
Parameter |
0 |
1 |
2 |
|
Weinen |
Gar nicht |
Stöhnen, Jammern, Wimmern |
Schreien |
|
Gesichtsausdruck |
Entspannt, lächelt |
Mund verzerrt |
Mund und Augen grimassiert |
|
Rumpfhaltung |
Neutral |
Unstet |
Aufbäumen, Krümmen |
|
Beinhaltung |
Neutral |
Strampelnd, tretend |
An den Körper gezogen |
|
Motorische Unruhe |
Nicht vorhanden |
Mässig |
Ruhelos |
Säuglinge:
Berner Schmerzscore für Säuglinge: Dieses Instrument ist für Frühgeborene und Termingeborene bis 4 Wochen nach dem errechneten Geburtstermin validiert (Cignacco, Mueller, Hamers, & Gessler, 2004). Bei der revidierten Version wird das Gestationsalter in der Interpretation berücksichtigt (Schenk et al., 2020).
Anwendung:
Beobachtung des Kindes während 2 Minuten:
- Beurteilung der drei verhaltensorientierten Schmerzindikatoren (Weinen, Gesichtsmimik und Körperspannung)
- Beurteilung des physiologischen Indikators Herzfrequenz.
Berechnung des Zwischentotals:
- Wenn Zwischentotal = 0 Punkte: Kein Schmerz
- Wenn Zwischentotal ≥ 1 Punkt: Beurteilung der drei Kontextfaktoren (Postmenstruelles Alter, Verhaltenszustand, Beatmung)
Berechnung des Gesamttotals:
- Gesamttotal = Zwischentotal + Kontextfaktoren.
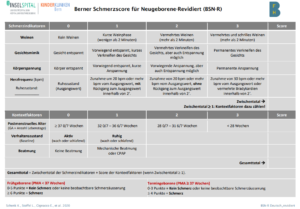
Beurteilung bei Frühgeborenen (PMA < 37 SSW):
- 0-5 Punkte = kein Schmerz oder keine beobachtbare Schmerzäusserung.
- ≥ 6 Punkte = Schmerz.
Beurteilung bei Termingeborenen (≥ 37SSW):
- 0-3 Punkte = kein Schmerz oder keine beobachtbare Schmerzäusserung
- ≥ 4 Punkte = Schmerz
Literatur:
Basler, H. D., Hüger, D., Kunz, R., Luckmann, J., Lukas, A., Nikolaus, T., & Schuler, M. S. (2006). [Assessment of pain in advanced dementia. Construct validity of the German PAINAD]. Schmerz, 20(6), 519-526. doi:10.1007/s00482-006-0490-7
Bächle-Helde, B. (2013). Wie weh tut es?. JuKiP-Ihr Fachmagazin für Gesundheits-und Kinderkrankenpflege, 2(04), 164-167.
Cignacco, E., Mueller, R., Hamers, J. P., & Gessler, P. (2004). Pain assessment in the neonate using the Bernese Pain Scale for Neonates. Early Hum Dev, 78(2), 125-131. doi:10.1016/j.earlhumdev.2004.04.001
Schenk, K., Stoffel, L., Bürgin, R., Stevens, B., Bassler, D., Schulzke, S., . . . Cignacco, E. (2020). Acute pain measured with the modified Bernese Pain Scale for Neonates is influenced by individual contextual factors. Eur J Pain, 24(6), 1107-1118. doi:10.1002/ejp.1555
Zielsetzung der perioperativen Schmerztherapie
- Die Bestrebungen sollten grundsätzlich dahin führen, bei jedem Patienten eine Schmerzlinderung zu erreichen, die das Schmerzniveau für den individuellen Patienten auf ein geringes und erträgliches Mass zu reduzieren vermag
- Wie unter oben erwähnt, geht man bei einem angegebenen NRS-Wert von <3 von einem erträglichen Niveau aus
- Neben der Gabe von Medikamenten beinhaltet die Schmerztherapie folgende Schwerpunkte:
Unerwünschte Nebenwirkungen von Schmerzen
- Blutdruckanstieg
- Aktivierung der Gerinnung mit thromboembolischen Komplikationen
- Erhöhte Infektionsgefahr
- Vermehrter Katabolismus
- Myodardischämie/-Infarkt u.a.m.
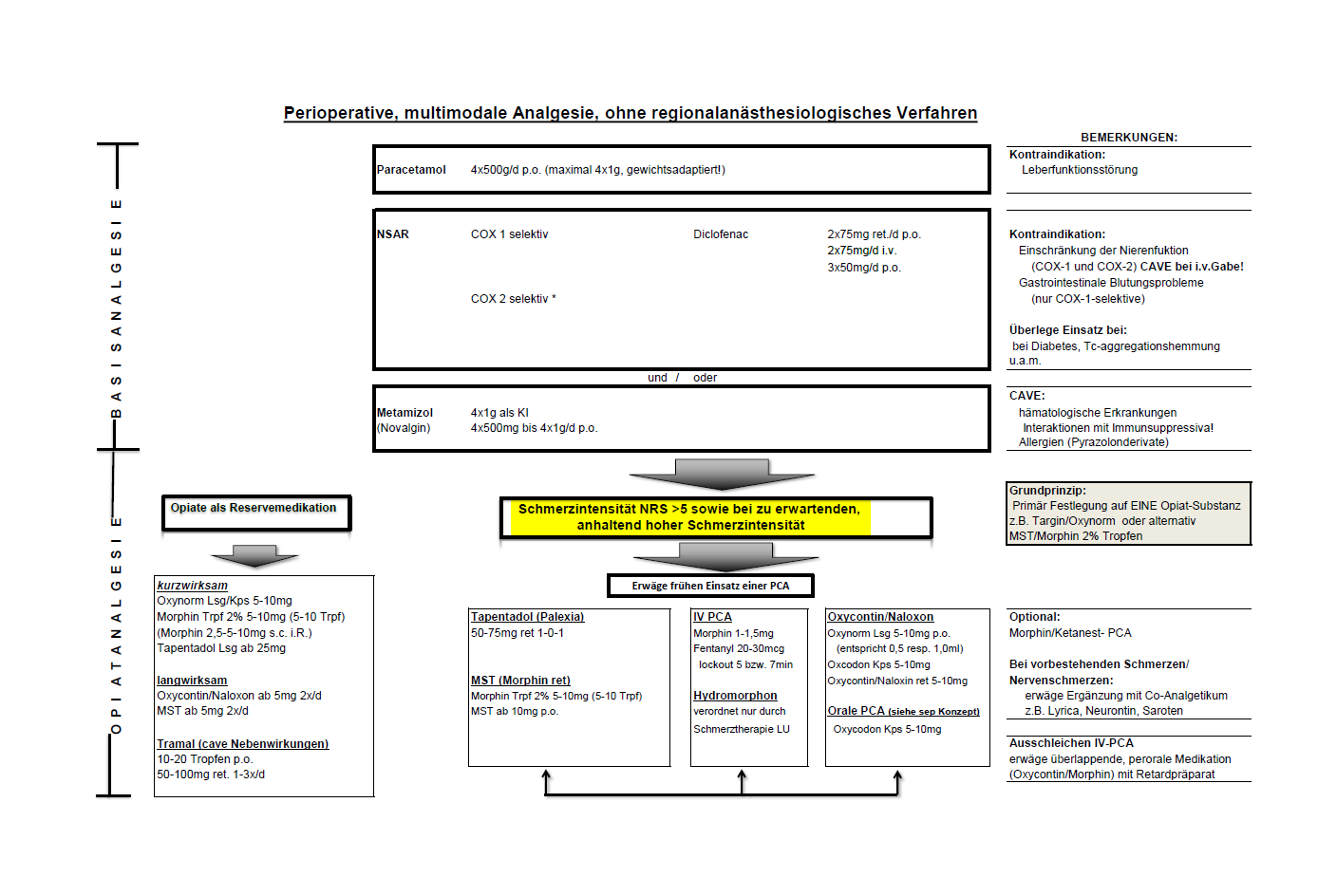
medikamentöse perioperative, multimodalen Schmerztherapie
- Der Analgetikabedarf nach einer Operation hängt von der Art und Lokalisation des Eingriffs ab und variiert sehr stark von Patient zu Patient
- Direkt postoperativ im Aufwachraum kann der Analgetikabedarf ein Hinweis auf den Bedarf an Schmerzmitteln im weiteren postoperativen Verlauf sein
- Indem der postoperative Schmerz in genau der gleichen Weise wie die Vitalparameter (Blutdruck, Puls, Atmung, Temperatur) evaluiert und protokolliert wird, kann bei jedem Patienten die Intensität der Schmerzen und die Wirksamkeit der Schmerztherapie genau verfolgt werden
- Dadurch ist es möglich, die Schmerzmittel aufgrund von objektiven Kriterien zu verabreichen und so nicht nur die Qualität, sondern auch die Sicherheit der Schmerzbehandlung zu erhöhen
- Der Patient muss informiert werden, dass es nicht normal und notwendig ist, nach einer Operation an starken Schmerzen leiden zu müssen, sondern dass eine gute Schmerzbehandlung wesentlich zu seiner schnellen Erholung beiträgt
- Er muss auch instruiert werden, zeitig ein zusätzliches Schmerzmittel zu verlangen (Reservemedikation), bevor die Schmerzen zu stark werden
- Die konventionelle systemische postoperative Schmerztherapie ist praktisch nie eine Monotherapie mit nur einem Medikament und einer Applikationsform, sondern immer multimodal bezüglich der Wahl der Medikamente und der Art der Verabreichungsform
- Eine Kombination von Nicht-Opiat-Analgetika mit Opiaten ist für zirka 80% der Patienten ausreichend
Grundsätze der postoperativen Analgesie
- Viele Analgetika entfalten ihre optimale Wirkung nach erreichen eines gewissen Konzentrationsspiegels im Blutplasma
- Dies erfordert jedoch eine zeitlich planmässige und regelmässige Verabreichung nach einem bestimmten Zeitintervall oder gegebenenfalls auch als kontinuierliche Infusion
- Grundprinzip der postoperativen Schmerztherapie bleibt das WHO-Stufenschema
- Alle zu dieser Basisanalgesie zählenden Medikamente gehören zur 1. Stufe des WHO-Stufenschemas. Bei einem bleibenden Schmerzscore über 3 ist die Kombination mit zusätzlichen Dosen von einem Opiat sehr wirksam
- Empfohlen wird des Weiteren die grosszügige Verabreichung von Analgetika vor schmerzauslösenden Aktivitäten (Mobilisation, Physiotherapie, Verbandwechsel u.a.m.)
- Primär ist die perorale Applikation von Analgetika den anderen Verabreichungsformen (insbesondere s.c. und i.m. ) vorzuziehen. Vorausgesetzt es bestehen keine Kontraindikationen (z.B. verlangte Nüchternheit, Probleme mit der Magenschleimhaut o.ä.)

Nicht Opiat-Analgetika
WHO Stufe 1, Paracetamol
- Als Basismedikation wird primär immer noch Paracetamol eingesetzt
- Die verstärkte Wirkung zusammen mit NSAR wird mittlerweile sehr kontrovers diskutiert
- Der Wirkmechanismus vom Inhaltsstoff Acetaminophen ist nach wie vor nicht restlos geklärt
- Obwohl Paracetamol ein nicht rezeptpflichtiges Medikament ist, hat es aber ein nicht geringes Nebenwirkungspotential
- Solange die empfohlene Tagesdosis von 3-4g/d bei Erwachsenen nicht überschritten wird besteht keine Gefahr
- Es gibt jedoch vor allem in den USA Anzeichen für einen deutlichen Anstieg von Leberversagen nach Paracetamoleinnahmen von über 6g/d
- In solch einer Situation hilft dann meist nur noch eine Lebertransplantation
- Grundsätzlich ist immer die perorale Applikationsform zu wählen
- Die parenterale Gabe wird einzig noch in entsprechenden, speziellen Fällen verordnet da sie im vergleich zur peroralen Form sehr teuer ist
WHO-Stufe 1, NSAR und Metamizol
- Zusätzlich ist bei fehlenden Kontraindikationen der Einsatz eines NSAR zu empfehlen, wobei da heute verschiedene Präparate mit unterschiedlicher, sogenannter Selektivität eingesetzt werden können
- Alle NSAR zeigen in ihrer Wirkungsweise eine bevorzugte Wirkung entweder am Enzym Cyclooxygenase 1 oder Cyclooxygenase 2 (wirksam im Prostaglandinsynthese-Stoffwechsel)
- Die COX-2-selektiven NSAR zeigen neben einer je nach Präparat unterschiedlichen Wirkstärke und –Dauer auch geringere Nebenwirkungen im Bezug auf gastrotintestinale Probleme, insbesondere Magenblutungen
- Mögliche Kontraindikationen von NSAR (z.B. renale Funktionseinschränkungen) müssen vor jedem Einsatz für den individuellen Patient evaluiert werden und die zeitliche Gabe möglicherweise eingeschränkt (einige, wenige Tage) oder die Medikation mit einem NSAR ganz vermieden werden (z.B. vorliegen einer diabetischen Nephropathie, Magenulcus).
- Vorläufig wird im LUKS Luzern perioperativ immer noch Diclofenac (Olfen) eingesetzt
- Bei Verschreibungen über 3 Tage sowie bei komplizierten Eingriffen, die entsprechend eine höhere Stressantwort des Körpers hervorrufen, ist die Kombination mit einem Protonenpumpeninhibitor in prophylaktischer Dosierung empfohlen
- Gleiches gilt selbstverständlich für Patienten, die bekannterweise auf eine Medikation mit NSAR mit Reflux oder Magenbrennen reagieren
- Bei traumatologischen Eingriffen/Osteosynthesen an grösseren Knochen werden NSAR weiterhin perioperativ für 48h verschrieben
- Aufgrund von Daten welche zeigen, dass längerfristig eingesetzte NSAR zu reduzierter Frakturheilung führen (Stichwort „reduced bone healing), obliegt es dem zuständigen Traumatologen/Orthopäden die NSAR nach 48h weiterzuverordnen oder zu sistieren
- Speziell sei auch hier noch einmal darauf hingewiesen, dass für ALLE wirbelsäulenchirurgischen Eingriffe bzgl. NSAR strikte die Anweisungen des SOP Wirbelsäulenchirurgie allgemein befolgt werden sollen
- NSAR der Wahl in der Wirbelsäulenchirurgie bleibt Celebrex 200mg
- Der routinemässige Einsatz eines COX-2-selektiven NSAR wird zur Zeit noch geprüft
- Bewährt als potentes, perioperatives Analgetikum hat sich Metamizol (Novalgin) welches problemlos peroral, als Tropfen und parenteral verabreicht werden kann
- Zu achten wäre da spezifisch auf das Vorliegen von Allergien sowie auf im Verlauf auftretende, hämatologische Probleme (Blutbildungsstörungen)
Opiat-Analgetika
- Perioperativ werden Opiate ausschliesslich parenteral eintitriert, wobei Opiate mit wesentlich stärkerer Wirkung (im Vergleich zu Morphin) verabreicht werden
- Um den individuellen Bedarf des Patienten postoperativ möglichst genau erfassen zu können wird empfohlen, bei nicht-onkologischen Patienten möglichst ein und die gleiche Substanz zu verwenden und nicht verschiedene Opiatmedikamente zu kombinieren
- Die meisten Präparate können als Opiat-Basismedikation in retardierter Form (kontinuierliche Abgabe des Medikamentes nach peroraler Einnahme in den nächsten 12 bis 24 Stunden) verordnet werden. Dazu gibt es für die meisten Opiate die Möglichkeit, Schmerzspitzen mit der gleichen, kurzwirksamen Form des
Medikamentes in Form von Tabletten, Kapseln oder Tropfen/Lösung zu behandeln - Bewährt haben sich da vor allem die Medikation mit Targin (retardiertes Morphin) sowie Oxynorm-Kapseln
- Bei Operationen, nach welchen unmittelbar postoperativ mittlere bis starke Schmerzen zu erwarten sind soll frühzeitig der Einsatz einer iv-PCA (Patient-controlled-Analgesia) erwogen werden
Atemdepression und Opiatmedikation
- Ein Patient, der Schmerzen > NRS 3 äussert untersteht einem sehr geringem Risiko aufgrund einer gewichtsadaptierten, intravenösen Opiatgabe schon nach kurzer Zeit eine Atemdepression zu entwickeln
- Generell besteht aufgrund von Ängsten und Vorbehalten in der Gabe von Opiaten eher die Gefahr, dass sie unterdosiert werden oder vielmehr noch zu wenig potente Opiate (z.B. Pethidin, Tramal) eingesetzt werden. (Vgl. dazu Tabelle Aequivalenzdosen von Opiaten)
- Generell wird empfohlen von einer Schmerzreservemedikation mit Pethidin s.c. abzusehen (siehe auch: „Hinweis über die Applikationswege von Opiaten“)
- Neben dem Umstand, dass Pethidin eine um den Faktor 10 geringere Wirkstärke zeigt, besitzen die Abbauprodukte (insbesondere der Metabolit Normeperidin) ein epileptogenes Potential
- Weiter können durch die atropin-ähnliche Struktur kardiale Nebenwirkungen wie Tachykardien ausgelöst werden
- Deshalb wird grundsätzlich der Einsatz von Pethidin nur noch empfohlen zur Therapie des postoperativen Shiverings
- Weiter muss auch die Reservemedikation mit Tramal (Tropfen oder in retardierter Form) gut überdacht werden. Hier können Komplikationen auftreten in Kombination mit Psychopharmaka, insbesondere mit Serotonin-Wiederaufnahme-Hemmern, die bei u.a. bei Depressionen eingesetzt werden. Des Weiteren zeigt Tramal (ca. 20 Mal geringere Wirkstärke als Morphin) ein sehr hohes Nebenwirkungspotential
Opiatverordnung bei Niereninsuffizienz
- Wie bei vielen anderen Medikamenten muss auch die Dosierung von Morphin bei eingeschränkter Nierenfunktion angepasst werden
- Durch den Abbau von Morphin können aktive Metaboliten gebildet werden, die durch die verzögerte Ausscheidung länger im Körper aktiv bleiben
- Bei Dialysepatienten wird Morphin nahezu vollständig eliminiert
- Diesbezüglich ist bei Patienten mit einer dialysepflichtigen Niereninsuffizienz eine Therapie mit Targin oder Oxycontin oder Buprenorphin den anderen Opiaten vorzuziehen
Opiatüberdosierung
- Als Primärsymptom bei einer beginnenden Opiatüberdosierung tritt eine Sedation ein
- Erst nach Auftreten einer opiatinduzierten Sedation kann durch die Wirkung von Opiaten am Hirnstamm durch weitere Opiatgaben eine Atemdepression ausgelöst werden
- In diesem Fall muss unverzüglich der Stationsarzt informiert werden
- Vorsicht ist auch geboten bei Gabe von Opiaten bei Kreislaufinsuffizienz (systolischer Blutdruck geringer als 90mmHg)
- Opiate können die Kreislaufstabilität zusätzlich negativ beeinflussen
Applikationswege von Opiaten, Aequivalenzdosen
Intravenöse Opiatgabe
- Ziel einer intravenösen Opiatgabe ist es, durch den schnellen Wirkungseintritt eine rasche Schmerzlinderung zu erzielen
- Nach intravenöser Gabe von Morphin ist dies innerhalb von einigen Minuten zu erwarten bis auch die Rezeptoren im ZNS durch das Medikament besetzt sein werden
- Empfehlenswert ist die 5-10 minütliche, repetitive Gabe von kleinen Mengen von Morphin, um das gewünschte Schmerzniveau < NRS 3 zu erreichen
- Zeitgleich mit der Schmerzreduktion soll auch das Auftreten von opiatinduzierten Nebenwirkungen (Übelkeit, Juckreiz, Sedation) beobachtet werden
- Bei Auftreten von Nebenwirkungen soll der zuständige Arzt informiert werden
- Neben einer vorübergehenden Sistierung der Opiatgabe soll dann der Wechsel auf ein Opiat mit ähnlicher Wirkstärke jedoch anderem Nebenwirkungsprofil in Betracht gezogen werden
- Voraussetzung bleibt natürlich in solchen Situationen, dass die Basisanalgesie entsprechend ausgebaut ist
Subkutane Opiatgabe
- Grundsätzlich sollte die parenterale Gabe von Opiaten (primär iv-PCA oder auch die Eintitrierung i.v. z.B. im Aufwachraum aber auch starken Schmerzzuständen auf der Abteilung) angestrebt werden
- Alternativ dazu empfiehlt sich die Gabe von peroralen Opiatpräparaten wie weiter oben erwähnt (retardierte Form als Basis sowie kurzwirksame Form für Schmerzspitzen)
- Die subkutane Gabe von Opiaten ist von der Steuerbarkeit her grundsätzlich weniger empfehlenswert
- Die Aufnahme der Opiate nach subkutaner Gabe ist abhängig von der Durchblutung des sehr individuell vorliegenden subkutanen Fettgewebes und deswegen sehr schlecht steuerbar
- Weiter ist mit einem verzögerten Wirkeintritt zu rechnen, der einer peroralen Gabe gleichkommt
- Bei repetitiven Gaben ist die Gefahr einer Überdosierung nicht unerheblich, wobei diese aufgrund des verzögerten Wirkungseintrittes erst nach einer gewissen Latenz auftreten wird
- Zuletzt sind die hartnäckigsten Fälle mit einer Opiat-Abhängigkeit jene, die nicht nur eine physisch und psychische Abhängigkeit für die Substanz zeigen, sondern auch noch konditioniert (gewöhnt) sind auf den Stich der Spritze, welche ihnen die Schmerzen lindern wird
Perorale Opiatgabe
- Sobald der Bewusstseinszustand, die Operation, die Schmerzstärke und der Patient im Allgemeinen es grundsätzlich für möglich halten, sollte auf eine perorale Gabe von Opiaten gewechselt werden
- Die heute verfügbaren Präparate mit verzögertem Wirkungseintritt (sog. Retardierte Opiate) ermöglichen eine kontinuierliche, gut steuerbare, suffiziente Möglichkeit der Analgesie von leichten bis starken Schmerzen
- Bei der Verordnung von retardierten Opiaten soll immer auch eine Reservemedikation verordnet werden
- Sinnvollerweise soll zur vereinfachten Festlegung der Grunddosis des retardierten Opiates, das gleiche Medikament in kurzwirksamer Form als Reservemedikation verordnet bzw. verabreicht werden
- So wären etwa die Kombinationen von MST (retardiertes Morphin) mit Morphin-Tropfen oder Targin-Tabletten in Kombination mit Oxynorm-Lösung zu erwähnen
Transdermale Opiatgabe
- Die transdermale Opiatgabe soll in der perioperativen Schmerztherapie eher zurückhaltend eingesetzt werden, ausser ein transdermales System wurde schon präoperativ zur Analgesie eingesetzt
- In Erwägung zu ziehen ist eine solche Medikation bei Patienten, die an chronischen Schmerzen leiden und vor allem auch in palliativen Situationen bei onkologischen Patienten
- In diesen Fällen sollen Opiate primär sehr grosszügig eingesetzt werden
- Die transdermale Applikation gewährt dem Patient eine grössere Autonomie und leicht geringere Nebenwirkungen im Vergleich mit der peroralen und vor allem der intravenösen Gabe
- Auch hier wird empfohlen, die Reservemedikation mit dem gleichen Medikament zu verordnen
- Zu erwähnen wäre hier die Kombination von Transtec TTS (Bupenorphin) mit dem kurzwirksamen, sublingual applizierten Temgesic oder die Kombination von Fentanyl TTS mit dem sehr potenten und kurzwirksamen Fentanyl (z.B. Effentora)
I.V.-PCA (Patient-controlled-Analgesia)
- Bei einer Versorgung mit einer iv-PCA mit Opiaten kann der Patient seine Analgesie nach Bedarf selbständig und autonom steuern
- Wichtig dabei ist es, den Patienten vorgängig über die Funktionsweise dieser „Schmerzpumpe“ zu informieren
- Je nach zu erwartender Schmerzintensität oder auch Nebenwirkungen können durch den verordnenden Arzt folgende Parameter gewählt werden: Opiat-Medikament, Dosis pro Bolus, zeitlicher Abstand zwischen den Boli sowie zusätzliche Beimischung eines Antiemetikums zur Vermeidung von Übelkeit und Erbrechen
- Studien belegen, dass Patienten unter der Therapie mit einer iv-PCA über eine raschere und suffizientere Schmerztherapie berichten als jene Patienten, welchen die Medikamente auf Verlangen durch die Pflege/den Arzt verabreicht werden
- In Situationen, wo der Patienten nicht fähig ist, die iv-PCA selber zu bedienen darf das Konzept nach entsprechender Verordnung und zwingender Rücksprache mit dem Arzt auch auf eine „iv-NCA“ (nurse-controlled-Analgesia) gewechselt werden
- Dabei bedient die Pflege die iv-PCA aufgrund von subjektiven Hinweisen für anhaltende, starke Schmerzen z.B. bei einem nicht kooperativen Patient
- Diese Möglichkeit Bedarf aber einer engmaschigeren Überwachung, da die Sicherheit nicht in gleichem Masse wie bei der Anwendung durch den Patienten selber gewährleistet ist
Vorhandene Medikamentenbeutel
| Medikament | Dosierung (Bolus) | Lockout |
|---|---|---|
| Morphin | 1mg oder 1.5mg | 5min oder 7min |
| Fentanyl | 20mcg oder 30 mcg | 5min oder 7min |
| Morphin + Ketanest | 1mg oder 1.5mg | 5min oder 7min |
- Im Bezug auf die Programmierung und das Handling der iv-PCA auf den Stationen verweisen wir auf den entsprechenden Beitrag im Blaubuch der Pflege
CAVE: Hydromorphon PCA: Eine Anwendung einer Hydromorphon PCA ist am LUKS Luzern kein Standard. Indikationsstellung erfolgt durch die ärztlichen Verantwortlichen der Schmerztherapie Luzern. Eine Verschreibung einer solchen PCA benötigt daher eine direkte Arzt-Arzt Kommunikation und eine Überprüfung der Pumpeneinstellung und Füllung im Vier Augen Prinzip.
Nebenwirkungen von Opiaten
- Die parenterale Gabe von Morphin geht in 30-40% mit Übelkeit und in rund 15-20% mit Erbrechen einher
- Aus diesem Grund wird die Verordnung eines Antiemetikums zu einer iv-PCA grundsätzlich empfohlen
- Es gelingt dadurch die Übelkeit bei ca. der Hälfte der Patienten zu reduzieren bzw. zu vermeiden
- Weiter besteht aber auch die Möglichkeit das Opiat zu wechseln (z.B. von Morphin auf Fentanyl)
- Mit einer guten Patientenaufklärung und –Information sollte vermieden werden, dass Patienten aus Angst vor Nebenwirkungen die PCA zu wenig bedienen und folgedessen unter stärkeren Schmerzen leiden
- Voraussetzung auch hier ist natürlich eine entsprechend ausgebaute, multimodale Basisanalgesie
Aequivalenzdosen und Wertigkeiten
- Bei der Gabe von morphinhaltigen Analgetika müssen zahlreiche Faktoren evaluiert werden
- Folgende Faktoren spielen in der Wahl des Medikaments eine wichtige Rolle:
- Allgemeinzustand/Komorbiditäten des Patienten (insbesondere Niereninsuffizienz)
- Vorgängige Opiattherapie
- Alter des Patienten
- Schmerzursache und anzunehmende Dauer der Medikation
- Akuter, chronischer, tumorbedingter Schmerz u.a.m.
- Im Wissen, dass die verschiedenen Opiate eine unterschiedliche Wirkstärke besitzen, ist es unabdingbar sich vor dem Einsatz eines Opiats Gedanken über die Aequivalenzdosis im Vergleich zur „Grundsubstanz“ Morphin zu machen
- Wichtig ist die Kenntnis über die Aequivalenzdosen von Opiaten auch dann vor allem, wenn Opiate perioperativ umgestellt werden
Die aktuell im gebräuchlichsten Opiat-Präparate sind in der folgenden Tabelle (1) aufgelistet:
| Opiat-Aequivalenzdosen/-Potenzen | |||||
| Medikament | Aequivalenz | Potenz | Indikation | Besonderes | kurzwirksame Form |
| Fentanyl | 0.01mg | 100 | Starke Sz, Tumor-Sz, Durchbruch-Sz | z.B. Effentora | |
| Burprenorphin | 0.01mg | 100 | Starke Sz, Tumor-Sz, Durchbruch-Sz, neuropathischer Sz | Einsetzbar bei Diayse | Temgesic |
| Hydromorphon | 0.13mg | 7.5 | Starke Sz, Tumor-Sz, Durchbruch-Sz | Hydromorphon unret. | |
| Methadon | 0.5-0.1mg | 2-14 | Starke Sz, Tumor-Sz, Durchbruch-Sz | Wirkstärke je nach Dosis | |
| Oxycontin/Targin | 0.5mg | 2 | Starke Sz, Tumor-Sz, Durchbruch-Sz, neuropathischer Sz | Einsetzbar bei Dialyse | Oxynorm Tropfen |
| Morphin | 1mg | 1 | Starke Sz jeglicher Art | Cave aktive Metaboliten! | Morphin unret. |
| Tramal | >10mg | 1/10 | Mittelstarke Schmerzen, neuropathischer Schmerz | Cave Interaktionen | Tramal unretardiert |
| Tapentadol | 2.5mg | 1:2.5 | Mittelstarke Schmerzen, neuropahtischer Schmerz | Mit NA-Reupdtakehemmer | Unretardiert:1ml = 20mg Lsg. 50mg Tabl. unret. |
| Co-Dafalgan | 10mg | 1/10 | Mittelstarke Schmerzen | CAVE Morphin Vorstufe, Metabolismus! |
Regionalanästhesie
- Regionalanästhesiologische Verfahren zur Schmerzlinderung sind wichtiger Bestandteil des multiodalen Konzepts der postoperativen Schmerztherapie
- Mit den Möglichkeiten der regionalanästhesiologischen Verfahren kann neben einer verbesserten Schmerztherapie auch das Auftreten von unangenehmen Nebenwirkungen reduziert werden (verursacht z.B durch die systemisch wirksamen Schmerzmittel)
- Mit der Regionalanästhesie werden rückenmarksnahe Verfahren (kontinuierliche Epiduralanalgesie, kontinuierliche Spinalanalgesie) bei Operationen im Thorax-, Abdomen-und Beckenbereich eingesetzt
- Bei Operationen an Extremitäten (Schulter, Arme, Beine) kommen kontinuierliche Nervenblockaden (mit Kathetern) an einzelnen Nerven zum Einsatz
Basisanalgesie
- Im Sinne des multimodalen Konzeptes soll die Basisanalgesie auch bei Anlage eines kontinuierlichen, regionalanästhesiologischen Verfahrens eingesetzt werden.
Regionalanästhesiologische Verfahren
- Die Hauptwirkung bei regionalanästhesiologischen Verfahren über einen perioperativ eingelegten Katheter wird durch das abgegebene Lokalanästhetikum erreicht
- Die dazu am häufigsten verwendete Substanz im LUKS ist Ropivacain
- Intraoperativ werden für die Schmerztherapie hohe Konzentrationen eingesetzt (z.B. 0,375-0,5%), die nicht nur die sensiblen, sondern auch die motorischen Nervenfasern lähmen
- Für die postoperative Analgesie kommen deutlich geringere Konzentration zum Einsatz (0,1-0,3%)
- Durch diese geringere Konzentration kann meistens eine unerwünschte Bewegungseinschränkung vermieden werden (geringe bis keine motorische Blockade)
- Bei Anlage von rückenmarksnahen Kathetern (im LUKS v.a. Epiduralkatheter) werden zur Verstärkung der analgetischen Wirkung auch noch Opiate (Fentanyl, Morphin) zugesetzt
- Durch die direkte Wirkung auf Opiatrezeptoren im Rückenmark kann so der analgetische Effekt verstärkt werden
- Dieser Effekt wird zu einem kleineren Teil über die lokale Wirkung am Rückenmark, zu einem deutlich grösseren Teil durch eine systemische Wirkung erzielt
Der postoperative Epiduralkatheter (epidural-PCA)
- Die postoperative Analgesie mit einem Epiduralkatheter ist bei richtiger Punktionshöhe und korrekter Lage des Katheters der „Goldstandard“ der postoperativen Schmerztherapie bei einem überwiegenden Teil von grösseren Eingriffen im Bereich des Thorax und des Abdomens
- Über die CADD Solis-Pumpe wird dem Patient kontinuierlich das Lokalanästhetikum (ev. mit zusätzlichem Opiat) abgegeben
- Ähnlich wie bei der iv-PCA mit Opiaten (siehe Kapitel PCA) kann der Patient zusätzliche Boli anfordern
- Im LUKS wird die epidurale Gabe von Medikamenten über einen Katheter als epidural-PCA bezeichnet
- Im Verordnungs-Set von EPIC (LUKIS) findet man die Bezeichnung unter epidural-PCA (Luzern)
- Die Wirkung epidural setzt nach Anforderung eines Bolus deutlich verzögert ein
- Demzufolge ist auch ein längeres Pausenintervall (im Normalfall 30min) erforderlich
1. Zahl: Anzahl ml der Medikamentenmischung pro Stunde
2. Zahl: Anzahl ml Bolus pro Anforderung
3. Zahl: Lockout-Zeit in min (Pausenintervall bis der nächste Bolus abgegeben wird)
- Die Darstellung nur mit Zahlen vereinfacht die Dokumentation
- Gemeint wäre im oberen Beispiel 6ml/h / 3ml pro Bolus / 30min Pausenintervall zwischen den Boli
Schmerztherapie über periphere Nervenkatheter
- Die gebräuchlichsten und häufigsten kontinuierlichen Nervenkatheter werden in folgender Tabelle dargestellt im Bezug auf die Operationslokalisation und der dazugehörenden Nervenblockade:
| Operationsgebiet | Nervenblockade | Fördermenge (ml/h) |
|---|---|---|
| Obere Extremitäten | 6 ml/h | |
| Schulter Proximaler Oberarm |
INTERSKALENUSKATHETER Katheter an die Nerven des Plexus brachialis am Hals bei der Skalenuslücke |
6 ml/h |
| Distaler Oberarm Ellbogen Vorderarm |
SUPRA- ODER INFRAKLAVIKULÄRER PLEXUSKATHETER Katheter an den Plexus brachialis unmittelbar über oder unter dem Schlüsselbein |
6 ml/h |
| Vorderarm Handgelenk Hand |
PLEXUSKATHETER Katheter an den Plexus brachialis im Bereich der Achselhöhle |
6 ml/h |
| Untere Extremitäten | 8 ml/h | |
| Hüfte Oberschenkel Knie |
FEMORALISKATHETER Katheter an den Nervus femoralis in der Leiste |
8 ml/h |
| Knie (Hinterseite), Unterschenkel bis Fuss |
ISCHIADIKUSKATHETER Katheter an den Nervus Ischiadikus (auf Höhe des Gesässes, proximalen oder distalen Oberschenkels oder in der Kniekehle) |
8 ml/h |
Praktische Hinweise im Umgang mit regionalanästhesiologischen Verfahren
Allgemeine Hinweise
- Perkutane Katheter sind immer infektionsgefährdet
- Eine sorgfältige Inspektion der Eintrittstelle des Katheters an der Haut sollte täglich durchgeführt werden (Rötung, Drucksdolenz)
- Um durch wiederholte Manipulationen/Verbandwechsel die Kontamination der Einstichstelle mit Keimen zu vermeiden, soll am ersten postoperativen Tag einmalig ein Verbandswechsel durchgeführt werden
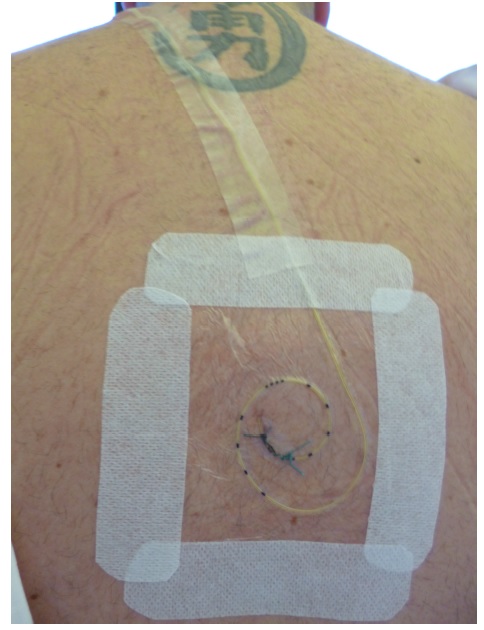
- Danach sollte nach Desinfektion und Entfettung der Haut die Einstichstelle mit einem durchsichtigen, sterilen Wundverband (Tegaderm) versehen werden
- So bleibt die Eintrittsstelle jederzeit sichtbar und es müssen nach Möglichkeit keine weiteren Verbandswechsel mehr durchgeführt werden
Dislokation
Obwohl die perioperativ angelegten Nervenkatheter im Allgemeinen mit einer Naht fixiert werden, können sie durch Bewegung oder Zug unabsichtlich herausgezogen werden
Infektionsrisiko
Das Infektionsrisiko bei liegenden Kathetern nimmt ab dem 3. postoperativen Tag exponentiell zu. Längere Verweildauern werden vom Team Schmerztherapie LUKS entsprechend verordnet und erfordern weiter engmaschige Kontrollen der Einstichstelle.
Sturzgefahr
Werden Nervenkatheter zur Analgesie einer unteren Extremität eingesetzt (Eintrittstelle Leiste oder tiefer) besteht Sturzgefahr
Zuständigkeit
Da die Kontrolle der Schmerzkatheter in den Verantwortungsbereich der Schmerztherapie LUKS gehört, sollen keine Schmerzkatheter ohne Rücksprache mit der Schmerztherapie LUKS gestoppt oder entfernt werden. Es besteht das Problem, dass bei fehlendem, kontinuierlichem Fluss der Katheter rasch verstopft und dann nicht mehr in Funktion gebracht werden kann. Weiter steigt auch das Infektionsrisiko weiter an.
Spezielle Hinweise zum Handling mit Epiduralkathetern:
- Den standardmässig durch die Apotheke hergestellten Medikamentenlösungen für die Epiduralkatheter wird neben Bupivacain auch noch ein Opiat (meist Fentanyl) beigesetzt (siehe Einleitung Kapitel 5)
- Da die Wirkung der Opiate zu 2/3 systemisch und nur zu 1/3 durch die lokale Rezeptorbesetzung bewirkt wird ist eine zusätzlichen Gabe von Opiaten bei Schmerzspitzen sehr vorsichtig abzuwägen.
Epiduralkatheter und Blutverdünnung
Epiduralkatheter dürfen nur bei regelrechter Blutgerinnung entfernt werden. Die Katheter werden ausschliesslich durch das Team Schmerztherapie LUKS entfernt.
Bei geplanter Entfernung des Epiduralkatheters ist es demzufolge wichtig, dass die Verordnungen der Schmerztherapie LUKS unbedingt umgesetzt werden (z.B. reduzierte Fragmin-Dosierung, Kontrolle der Gerinnungsparameter)
Unbeabsichtigtes Entfernen oder Herausrutschen des Katheters
Ein akzidentell entfernter oder herausgerutschter Katheter wird mit einer Etikette des Patienten versehen. Der Vorfall wird dem Team Schmerztherapie LUKS gemeldet. Dieser führt eine weitere Pain-Visite durch und untersucht den Katheter auf dessen Vollständigkeit.
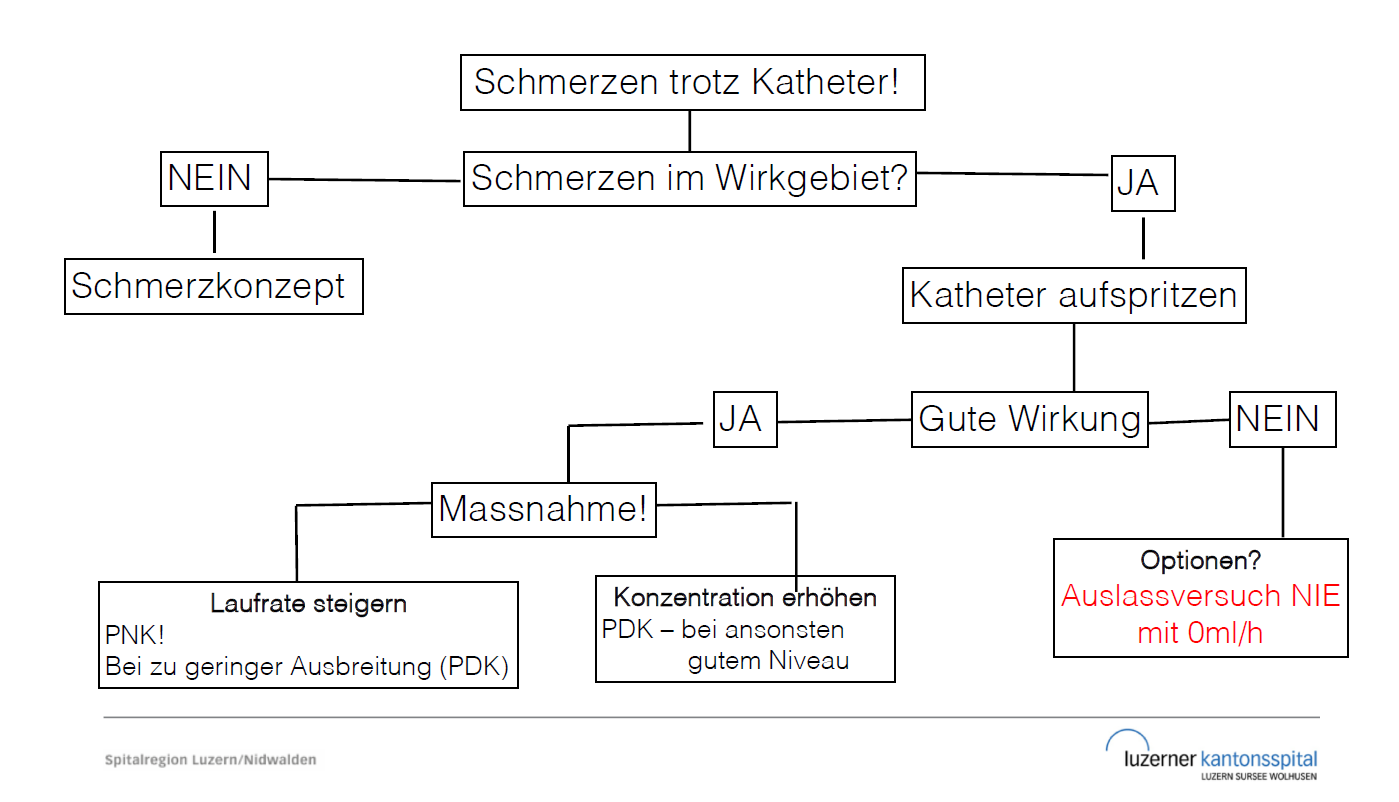
Ungenügende Schmerzkontrolle trotz Epiduralkatheter
Neben einer möglicherweise zu geringen Dosierung müssen verschiedene weitere Punkte in Betracht gezogen werden. Zu den möglichen technischen Ursachen gehören:
Verschobene Katheterlage
Defekte Medikamentenzufuhr (z.B. Pumpen-Dysfunktion, abgeknickter Katheter/Schlauch)
Leck an den Verbindungsstücken zwischen Schlauch und Katheter
Leck im Bereich des Bakterienfilters
Symptomatik des Patienten auch an eine operationsbedingte Komplikation zu
denken, z.B. Abszessbildung, Peritonitis, Darmverschluss, Nahtinsuffizienz u.a.m.
Insuffiziente Zentrale/Periphere Nervenkatheter mit Schmerzexazerbation
Aufspritzen PNK/PDK
Periphere Nervenkatheter
- Aufspritzen mit Ropivacain 0.5% empfohlen
- Obere Extremitäten : (5ml)- 10ml – (15ml)
- Untere Extremitäten (10ml) – 15ml – (20ml)
- Bei Verdacht auf “Fehllage” erwäge Einsatz von sogenannter “Testdosis”
- Testdosis: Lidocain 2% + Adrenalin unter Monitoring zum Ausschluss einer intravasalen Lage
Zentrale Nervenkatheter / Epiduralkatheter
- Aufspritzen entweder mit “Testdosis” Lidocain 2% + Adrenalin 2-5ml unter Monitoring (Ausschluss Fehllage!)
- Alternativ Gabe eines Lokalanästhetikums in höherer Konzentration
- Bei laufendem Bupivacian 0.125% + Fentanyl (Laufrate 6ml/h, Bolus 3ml alle 30 min) –> Gabe von 2-5ml Bupivacain 0.25% unter Monitoring
- Bei laufendem Bupivacain 0.25% (Laufrate 5ml/h, Bolus 3ml alle 30 min) –> Gabe von 2-3ml Bupivacain 0.375% unter Monitoring
Pflegerische Verrichtungen
Überwachung des Patienten im Rahmen der postoperativen Schmerztherapie
Intravenöse Schmerztherapie (iv-Gabe und iv-PCA)
Schmerzerfassung
Regelmässige Schmerzerfassung und Anpassung der Schmerztherapie gemäss Kapitel Schmerzerfassung
Gabe von Sauerstoff
Eine Sauerstoffgabe bei Patienten mit einer intravenösen Opiat-Therapie postoperativ wird in den ersten 24h notwendig (2-4l nasal). Dadurch kann eine ungenügende Sauerstoffsättigung vor allem auch nachts vermieden werden. Weiter wird so auch die Wahrscheinlichkeit für das Auftreten von Wundinfektionen gesenkt.
Praktische Hinweise
Praktische Hinweise über die Funktion und das Handling mit iv-PCA sind dem Pflegehandbuch Chirurgie LUKS zu entnehmen.
Epidurale Medikamentengabe (epidurale PCA)
Schmerzerfassung
Eine regelmässige Schmerzerfassung soll gemäss Kapitel Schmerzerfassung durchgeführt werden. Bei ungenügender Analgesie kann die basale Flussrate um 1-3ml pro Stunde erhöht werden. Eine Rücksprache mit dem Dienstsarzt Schmerztherapie (Tel 1510) ist in diesem Fall zwingend erforderlich.
Sedation/Atemdepression
Die Wahrscheinlichkeit für eine Atemdepression durch das epidural applizierte Morphin bzw. Fentanyl ist sehr gering. Bei liegendem Epiduralkatheter sowie epidural-PCA ist jedoch mit zusätzlichen Gaben von systemischen (iv.) Opiaten Vorsicht geboten. Grundsätzlich wäre eine verbesserte Analgesie durch Anpassung der epidural-PCA anzustreben. Sollte dies nicht innerhalb von 30 – 60min zu einer suffizienten Besserung führen, soll die stationäre Schmertherapie (Tel 1510) informiert werden.
Hypotonie/Blutdruckschwankungen
Bei Lageänderungen der Patienten kann es zu Blutdruckabfällen kommen. Durch eine Hypovolämie oder sehr ausgedehnter Ausbreitung der Wirkung können vermehrt Hypotonien auftreten. Als Sofortmassnahme werden Kopftieflage (für kurze Zeit) sowie die Gabe von Flüssigkeit (Ringerfundin/NaCl 0.9%) empfohlen.
Epiduralkatheter und intravenöser Zugang
Grundsätzlich soll während der Versorgung mit einem Epiduralkatheter immer auch ein intravenöser Zugang (kann auch abgestöpselt werden)vorhanden sein (siehe vorangegangener Punkt). Bei längeren Liegedauern von Epiduralkathetern (z.B. onkologische Patienten, Rippenserienfrakturen o.ä.) wird durch das Team der Schmerztherapie entschieden, ob auf einen intravenösen Zugang verzichtet werden kann.
Komplikationen und Infektionen
Auf der täglichen stationären Schmerz-Visite wird das Niveau der Ausbreitung der Blockade geprüft durch Testung der Sensibilität bzw. des Schmerzempfindens. Grundsätzlich wird die Kraft und Motorik meistens nicht beeinflusst. Sollten plötzlich erhebliche sensible oder motorische Defizite auftreten, soll die epidural-PCA unverzüglich gestoppt werden und der Dienstarzt Schmerztherapie informiert werden (Sucher Tel. intern 1510). Rückenschmerzen im Bereich der Katheteraustrittsstelle können ein Zeichen für eine beginnende Infektion darstellen und müssen deshalb ernst genommen werden. Der Dienstarzt Schmerztherapie muss ebenfalls umgehend informiert werden.
Management von Blasenkathetern bei liegendem Periduralkatheter
Mit der frühzeitigen Entfernung von Blasenkathetern soll das Risiko eines Harnwegsinfektes vermindert und sekundär die Mobilität der Patienten forciert werden. Postoperativ haben Patienten mit einer epiduralen Analgesie einen Blasenkatheter. Eine epidurale Ausbreitung des Lokalanästhetikums in den Bereich der Becken-/Unterbauchregion wie auch die Gabe von Opiaten epidural kann zu Blasenentleerungsstörungen führen.
So nicht anderweitig verordnet, kann der Blasenkatheter nach viszeralchirurgischen Eingriffen am 2. Tag postoperativ, bis spätesens 12 Uhr gezogen werden, sofern die Flussrate 6ml oder weniger beträgt und/oder der Patient bereits mobilisiert ist. (Fast-Track-Patienten ausgenommen-> siehe separates Konzept im Blaubuch Pflege. So bei einer Flussrate von > 6 (also z.B. 9/3/30) das caudale Niveau nach Testung durch das Team Schmerztherapie LU im Bereich der thorakalen Segement liegt (bis Th12 und nicht tiefer) kann der DK gleichwohl entfernt werden. Die Folgen bei Infektionen durch zu lange liegende Blasenkatheter und damit assoziierten Infektionen sind wesentlich gravierender als die unangenehme Situation, einem Patient bei Miktionsproblemen ohne Katheter wieder einen Katheter legen zu müssen. Das Führen eines Miktionsprotokolls in den ersten 6 Stunden danach ist obligat, damit ein Harnverhalt oder eine Überlaufblase frühzeitig erkannt werden kann. Bei Zweifeln kann auch ein Bladder-Scan durchgeführt werden, um eine Überlaufblase zu verifizieren.
Bei thoraxchirurgischen Eingriffen kann optional der Blasenkatheter bereits am 1.postoperativen Tag gezogen werden, vorausgesetzt auch diese Patienten sind bereits mobilisiert. (dies betrift, wenn überhaupt vor allem jene Patienten, die als erste auf dem OP-Programm operiert wurden und um die Mittagszeit schon wieder auf der Station sind. Auch bei diesen Fällen soll in den ersten 6 Stunden nach Entfernung ein Miktionsprotokoll geführt werden.
Blutverdünnung/Thromboseprophylaxe
Sowohl für die Einlage wie auch das Entfernen eines Epiduralkatheters müssen die im Labor bestimmten Faktoren der Blutgerinnung (Thrombozyten, INR, anti-F-Xa) im Normbereich liegen. Wird eine umgehende Antikoagulation mit Marcoumar oder Fragmin/Liquemin notwendig, muss der Dienstarzt Schmerztherapie beigezogen werden. Weiter muss der Dienstarzt Schmerztherapie auch über Medikationen mit Thrombozytenaggregationshemmern (Aspirin, Plavix u.a.m., häufig von den Kardiologen verabreichten Medikamente) informiert werden. Der Katheter soll vor Beginn einer peroralen Dauermedikation entfernt werden.
Verbandwechsel/Wundhygiene
Verbandswechsel
Sollte sich der Verband gelöst haben oder eingeblutet sein soll das Team Schmerztherapie LUKS informiert werden (Dienstarzt Tel intern 1510, Pain Nurse Tel intern 1432)
Durch den durchsichtigen Wundverband gelingt die Kontrolle der Katheter-Austrittsstelle einfacher. Bei plötzlicher Rötung oder Druckdolenz muss unverzüglich der Dienstarzt Schmerztherapie (Tel intern 1510) informiert werden.
An speziellen neuen Katheterbefestigungen, die möglicherweise auch im Bezug auf ihre Funktionalität getestet und vom Team Schmerztherapie LUKS evaluiert werden sollen keine Manipulationen durch das Pflegepersonal der Stationen erfolgen
Der Katheter wird am Rücken neben den Dornfortsätzen entlang bis in die Schulterregion auf der Haut angeklebt
Das restliche Katheter-Stück von der Schulter bis und um den Filter wird beidseitig mit Transpore „geschient“
Der Filter wird an den vom Aufwachraum (AWR) konfektionierten Fixierungen mit Klettverschluss am Patientenbett oder den Kleidern/Spitalnachthemd fixiert
Bezüglich Wechsel von Beuteln und Besteck verweisen wir auf die Richtlinien im Blaubuch der Pflege
Verbandswechsel bei Epiduralkathetern
Wundvebände, so es keine speziellen Fixationen sind, werden perioperativ mit Telfa, einer sterilen Gazekompresse und Mefix angelegt, da es initial häufig aus der Einstichstelle leicht bluten kann. Am ersten postoperativen Tag wird der Wundverband wenn immer möglich mit einem durchsichtigen Wundverband (Tegaderm) erneuert.
Verbandswechsel bei peripheren Nervenkathetern
Ist am ersten postoperativen Tag der Wundverband blutig, soll ein Verbandswechsel durchgeführt werden. Der Wundverband soll mit IV3000/Tegaderm so angebracht werden, dass die Einstichstelle sichtbar bleibt, der Katheter mit einer Schlaufe zusätzlich unter dem Klebeverband befestigt wird. Ist der Wundverband bereits durchsichtig und nicht blutig, soll kein Verbandswechsel durchgeführt werden. Die Inspektion der Einstichstelle wird wiederum durch das visitierende Personal der Schmerztherapie geleistet.
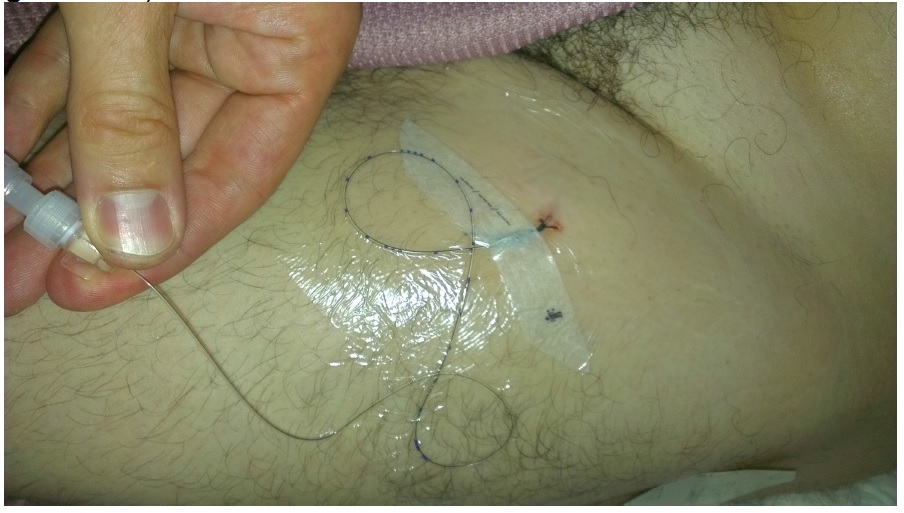
Exemplarischer Wundverband eines Katheters an den Nervus Femoralis links (idealerweise wird auch hier der durchsichtige Folienverband mit Mefix geschient)
Tägliche postoperativen Schmerzvisite/Katheter-Entfernung
Im Rahmen täglichen postoperativen Schmerzvisiten wird die Qualität der Analgesie, die Ausbreitung und Einstellung der epidural-PCA durch die Pain Nurse oder den Dienstarzt Schmerztherapie kontrolliert. Weiter wird auch die Katheteraustrittsstelle inspiziert.
Epidurale Katheter wie auch Nervenkatheter werden nur durch Mitarbeiter der Schmerztherapie LUKS entfernt. Davon ausgenommen sind chirurgisch eingelegte Katheter am Beckenkamm oder intraartikulär.
Intraoperativ durch die Chirurgen eingelegte Katheter an Nerven wie z.B. am N. ischiadicus (Gefässchirurgie bei Amputationen) oder Intercostal (Herz-Thoraxchirurgie) werden, da es sich um Nervenkatheter handelt, ebenfalls von der Anästhesie erfasst und visitiert. Bei Unklarheit soll Kontakt mit dem Dienstarzt Schmerztherapie aufgenommen werden um zu klären, welche Pumpe an den Katheter installiert werden soll.
Die Reduktion der Dosis der epidural-PCA, Reduktion der Fragmin-Dosis sowie eine geplante Katheterentfernung wird der Pflege schriftlich, ev. auch mündlich kommuniziert. Laborkontrollen der Blutgerinnung vor Katheterentfernung sollen möglichst führmorgens abgenommen werden und falls nötig notfallmässig bestimmt werden. Die Laboranalyse sollte bei Beginn der akut-Schmerz-Visite um 0730 Uhr den Mitarbeitern der Schmerztherapie vorliegen.
Medikamentöse Schmerztherapie in der Notfallstation
Zielsetzungen der Schmerztherapie im interdisziplinären Notfallzentrum
- Die Richtlinien und SOP`S über die Schmerztherapie im Interdiziplinären Notfallzentrum (INZ) LUKS sind über die Internetplattform www.notfallstandards.ch abrufbar
- Der Schmerz ist bei einem grossen Teil der Patienten auf dem chirurgischen Notfall das Leitsymptom, dass zur Vorstellung des Patienten geführt hat
- Dementsprechend erwartet der Patient neben der Abklärung und Behandlung der Schmerzursache vordringlich eine möglichst rasche und effiziente Behandlung seiner Schmerzen (1)
- Werden die Schmerzen nicht adäquat behandelt, wirkt sich dies negativ aus und zwar sowohl auf die Beurteilung der Behandlungsqualität wie auch auf die Zufriedenheit mit der Notfallbehandlung insgesamt
- Die Furcht vor Nebenwirkungen der medikamentösen Schmerzbehandlung führt beim Patienten häufig zu einer primären Ablehnung der Analgesie (2), auch auf seiten der Ärzte bestehen noch immer Vorbehalte v.a. gegenüber einer Opiatanalgesie in der Meinung, diese würde die klinische Beurteilbarkeit des akuten Abdomens beeinträchtigen
- Diese Ansicht wurde bereits mehrfach widerlegt (3,4)
- Obwohl uns mit der Visual Analogue Scale (VAS) oder der Numeric Rating Scale (NRS) einfache und gut abgestützte Instrumente für die subjektive Beurteilung der Schmerzintensität durch die Patienten zur Verfügung stehen, ist der insuffiziente Analgetikagebrauch u.a. aus oben genannten Gründen noch immer weit verbreitet, zudem fehlt meist eine standardisierte Reevaluation nach initialisierter Analgesie (5)
- Sollte die orale Schmerztherapie in der Regel dem WHO-Stufenschema folgen, so verbietet sich dieses Vorgehen zumeist bei den akuten und häufig intensiven Schmerzbildern auf dem chirurgischen Notfall
- Hier sollten, in Abhängigkeit der subjektiven Schmerzintensität, rasch schnellwirksame i.v. Analgetika bis hin zu Morphin zur Anwendung kommen
- In der Anwendung von Morphin hat sich ein schmerzadaptiertes Titrationsverfahren bewährt, dass einen risikoarmen Einsatz durch das Pflegepersonal oder sogar durch den Patienten selbst (PCA) zulässt (6,7)
Die Schmerzbehandlung bestimmt die Patientenzufriedenheit wesentlich mit: Eine suffiziente Analgesie muss ein fester Bestandteil im Behandlungsprozess sein
Die Behandlung starker Schmerzen muss rasch erfolgen: auch vor dem ersten Arztkontakt muss eine suffiziente Analgesie initiiert werden können.
Das subjektive Schmerzempfinden des Patienten ist ausschlaggebend: die subjektive Schmerzintensität wird mittels VAS gemessen und die Analgesie
darauf abgestimmt. Der Therapieerfolg wird mit VAS nachgemessen.
Die Anwendung von Morphin ist in einem festen Protokoll effizient, sicher und behindert die Diagnostik nicht: Morphin soll bei starken Schmerzen möglichst rasch intravenös angewendet werden.
Literatur
1) Fosnocht DE et al.: Patient expectations for pain medication delivery. Am J Emerg Med: 19(5);2001
2) Singer AJ et al. Triage pain scores and the desire for and use of analgesics. Ann Emerg Med: 52(6); 2008
3) Thomas SH , Silen W. Effect on diagnostic efficiency of analgesia for undifferentiated abdominal pain, BJS:90;2003
4) Zoltie N, Cust MP. Analgesia in the acute abdomen. Ann Royal Coll Surg:68;1986
5) Todd KH et al. Pain in the emergency department: PEMI Multicenter Study. J Pain: 8(6); 2007
6) Chang A et al. Randomized clinical trial comparing a patient-driven titration protocol of i.v. hydromorphone with traditional physician-driven management of ED patients with acute severe pain. Ann Emerg Med:54(4);2009
7) Lvovschi V et al. Intravenous morphine titration to treat severe pain in the ED. Am J Emerg Med:26;2008)
Zuständigkeit für die Schmerztherapie im LUKS Luzern
Gültigkeit/Dauer von postoperativen Verordnungen
- Die postoperative Schmerzmedikation wird durch die Anästhesie in der Regel bis zur nächsten ärztlichen Visite auf den Stationen verordnet
- Die erforderlichen Anpassungen dieser Verordnungen erfolgen auf den Abteilungen in der Regel durch den Stationsarzt/-ärztin und deren Vorgesetzte
- Idealerweise werden die Vorgaben (siehe Kapitel Konzept der medikamentösen, perioperativen, multimodalen Schmerztherapie und Konzept der perioperativen Schmerztherapie mit Methoden der Regionalanästhesie) im Sinne des multimodalen Therapiekonzeptes weiterverfolgt
- Neben einer ausgebauten Basisanalgesie soll die Opiatmedikation als Reserve-oder Fixmedikation entsprechend grosszügig verordnet werden
- Prinzip „hit hard and early“
- Mit Verlassen des Aufwachraumes geht die Verantwortung von der Anästhesie an die Ärzte und Pflegenden der Abteilungen über.
Verordnung einer IV-PCA
- Der Stationsarzt kann nach Rücksprache mit dem Dienstarzt Schmerztherapie (Tel intern 1510) oder der Pain Nurse (Tel intern 1432) bzw. dem Aufwachraum selbständig eine IV-PCA verordnen
- Das Pflegepersonal ist im Umgang mit den IV-PCA-Pumpen geschult
- Bei Problemen hilft das Team der Schmerztherapie selbstverständlich gerne weiter
Anmeldung Schmerzkonsil
- Bei komplexen postoperativen Schmerzproblemen soll eine Absprache zwischen Pflegedienst, Stationsarzt und dem Dienstarzt Schmerztherapie stattfinden
- Bei speziellen Fragestellungen und Problemen kann ein Schmerzkonsil angemeldet werden unter Verordnungen „Konsilien Anästhesie“
- Dann in der Auswahl – “Konsil Schmerztherapie” wählen. Hilfreich ist ein Anruf auf den Dienstarztsucher stationäre Schmerztherapie Tel intern 1510 für die Anmeldung und Angabe der Patientendaten sowie Besprechung der Fragestellung. In dringenden Fällen kann die Anmeldung des Konsils im LUKIS auch nach der telefonischen Anmeldung (dann aber zwingend durch den zuständigen Arzt) eingefügt werden.
Visite von rückenmarksnahmen und peripheren Nervenkathetern
- Nach Einlage eines Epiduralkatheters (epidural-PCA) oder eines kontinuierlichen Nervenkatheters wird die Analgesie durch die visitierende Pain Nurse oder den Dienstarzt Schmerztherapie mitkontrolliert und/oder weiterverordnet
- Änderungen an der Schmerzmedikation insbesondere die Verordnung von Opiaten per oral sollen wenn immer nach Rücksprache mit dem Team der Schmerztherapie vorgenommen werden
- Die Lösungen der epidural-PCA enthalten zu einem Grossteil Lokalanästhetika aber auch einen kleinen Opiatanteil
Wechsel von Bestecken an epidural-PCA
- Gemäss Hygienerichtlinien soll das Besteck einer epidural-PCA alle 4 Tage gewechselt werden
- Im Gegensatz zum Besteckwechsel an einer IV-PCA, welcher durch die Stationspflege selbständig durchgeführt werden kann, wird das Besteck der epidural-PCA durch das Team der Schmerztherapie gewechselt.
Postoperative Übelkeit und Erbrechen (PONV)
(Englisch: postoperative nausea and vomiting, kurz PONV)
Übelkeit und Erbrechen nach einem operativen Eingriff wird von den Patienten als sehr unangenehm und belastend empfunden.
Risikofaktoren für PONV
- Medikation mit Opiaten (sowohl systemisch als auch epidural)
- Weibliches Geschlecht
- Nichtraucher
- PONV i.R. früherer Eingriffe oder bekannte Reisekrankheit
Weitere Faktoren, welche Übelkeit und Erbrechen ebenfalls beeinflussen können
- Entleerungsstörungen im Magen und Darm
- Störungen des Innenohres
- Blutdruckschwankungen mit schlechter Durchblutung des Hirnstammes und Reizung des Vagusnerven
Massnahmen
- Im Wissen um die Häufigkeit von PONV (16-20%) werden perioperativ durch die Anästhesie sehr grosszügig Antiemetika appliziert, um das Risiko möglichst tief zu halten
- Wechsel der Opiatmedikation auf ein anderes Opiat oder Beendigung der Opiatmedikation
- Epidurale Medikation nur mit Bupivacain ohne Fentanyl oder Morphin nach Rücksprache mit dem Team der Schmerztherapie
Medikamentöse Therapie
- Die perioperativ begonnene Medikation mit Navoban (Ondansetron) kann auch postoperativ weitergeführt werden
- Paspertin (Metoclopramid) ist gegen PONV unwirksam
Pharmakodynamik der Analgetika
- Je nach Operation, kann eine Schmerzbefreiung nur schon durch verschiedene Medikamente der WHO-Stufe 1 erreicht werden. Die Wirksamkeit dieser Medikamente wurde vielfach untersucht.

Erklärung der Tabelle
- Die im rechten Teil der Tabelle aufgeführte Zahl „NNT“ bedeutet Number needed to treat
- Wie zum Beispiel bei Ibuprofen 400mg 2.8 bedeutet, dass 2,8 Patienten Ibuprofen einnehmen müssen, damit ein Patient eine Schmerzlinderung von über 50% erfährt
- Die anderen verspüren sicherlich auch eine Schmerzlinderung, wobei diese unter 50% liegt
- Es zeigt sich also, dass Ibuprofen 400mg jenes Medikament ist, welches am wirksamsten eingesetzt werden kann und dies im Vergleich auch mit Morphin 10mg i.m. oder auch Tramadol 100mg
- Ibuprofen ist in der NNT vergleichbar mit Diclofenac (Olfen/Voltaren)
- Nicht zuletzt deshalb, weil man davon ausgeht, dass sich die Wirkung der verschiedenen Medikamente schlussendlich addieren, werden die Medikamente in der Basisanalgesie generell miteinander kombiniert.
Strategische Überlegungen in der praktischen Anwendung von Analgetika
- Die grundlegende Strategie sieht vor, eine möglichst frühzeitige, optimale Schmerzlinderung zu erzielen mit einer individuell angepassten Dosis der verschiedenen Analgetika („hit hard and early)
- Durch die frühzeitige, teilweise schon präoperativ begonnene Blockade von verschiedenen Systemen wie Ionen-Kanäle, Enzyme und Rezeptoren kommt es zu einer deutlich reduzierteren Stressantwort des Körpers mit reduzierter Ausschüttung diverser Substanzen
- Dadurch kann erreicht werden, dass die Schmerzintensität für den Patienten subjektiv stets gering bis erträglich erscheint (< NRS 3) und sich zudem rascher eine Abnahme der Schmerzintensität einstellen wird
- Weiter können durch diese Strategie unangenehme Nebenwirkungen vermieden und Medikamente und deren Kosten eingespart werden
- So wie empfohlen wird, dass neben einer ausgebauten Basisanalgesie eine frühzeitige Opiattherapie (PCA/p.o./i.v.) eingesetzt werden soll
- Bei mit nachlassender Schmerzintensität gemäss dem Stufenschema soll die Schmerztherapie wieder reduziert werden
- Auch hier empfiehlt sich aber bei Sistierung einer fixen Opiatmedikation, eine Reservemedikation beizubehalten
- Die individuelle Morphinkonzentration im Plasma für eine adäquate Schmerzlinderung kann leicht um den Faktor 10-30 variieren
- Es bleibt notwendig den Äusserungen des Patienten mit Schmerzen > NRS 3 Glauben zu schenken
- Dennoch müssen Boli entsprechend vorsichtig eintitriert werden
- Insbesondere bei der rascheren Wirkung von i.v. Opiaten sollen in den Abteilungen 10-15min abgewartet werden, bis der nächste Bolus verabreicht
- Schliesslich sollen dadurch nicht nur Nebenwirkungen, sondern auch eine Überdosierung vermieden werden
- Untenstehend sind die im LUKS am häufigsten verwendeten Analgetika sowie Antiemetika aufgeführt
- Die wichtigsten Angaben zu Indikation, Dosierung, Wirkung und Nebenwirkungen sind tabellarisch zusammengefasst
- In Klammer sind die aktuellen Generika aufgeführt.
Pharmakologie der gebräuchlichsten Schmerzmedikamente und Antiemetika
| Medikament | Indikation | Dosierung | Wirkungseintritt | Wirkdauer | Kommentar |
|---|---|---|---|---|---|
| Bupivacain | Lokalanästhetikum zu Nervenblockade | Durch Pain-Dienst verordnet | 5-15 min | Single-shot: Stunden Katheter: Dauerhaft |
Vorsicht: Hypotonien, Intoxikation, Motorische Lähmung |
| Celecoxib (Celebrex) |
Mässige Schmerzen Knochenschmerzen Rheumatologische Leiden |
2x200mg/d p.o. | Nach 1-2 h | 12 h | Sogenannt COX-2-selektiv Weniger GI-Blutungen |
| Paracetamol (Dafalgan) |
Leichte Schmerzen Fieber |
Max. 100mg/kg KG I.d.R. 4x500mg/d p.o. |
Nach 1-2 h | 4-6 h | Vorsicht bei Leberfunktionsstörungen. Kombination mit NSAR sinnvoll |
| Droperidol | Übelkeit und Erbrechen | Zusatz in PCA | Innert Minuten | Unterschiedlich | Psychische Reaktionen Hypotonien Rhythmusstörungen Früh- und Spätdyskinesien (pathologische Bewegungsmuster–> Nicht beim Parkinsonpatienten geben |
| Fentanyl | Starke Schmerzen | 1-3 mcg/kg KG i.v.als i.v.-PCA In epidural-PCA als Zusatz 2mcg/ml |
3-5 min i.v. 10-20 min in epidural-PCA |
20-40 min | Achtung Überdosierung: Sedation, Atemdepression, NW: Nausea, Juckreiz, Euphorie, Dysphorie |
| Etorecoxib (Lodine) |
Mässige Schmerzen | 2x300mg/d oder 1x 600mg ret/d p.o. | 30-60 min | 6-24 h | COX-2 selektives NSAR Weniger GI-Blutungen |
| Morphin (i.v.) | Mässige bis starke Schmerzen | i.v. mg-weise eintitrieren Individuelle Dosis |
15-30 min | Variabel | Achtung Überdosierung: Sedation, Atemdepression NW: Nausea, Juckreiz, Euphorie, Dysphorie |
| Morphin (MST) (p.o.) |
Mässige bis starke Schmerzen | Sehr variabel Ab 2x 10mg/d p.o. |
1-3 h | Langwirksam 6-12 h (retardwirkung) |
Bei anhaltenden Schmerzzuständen Ausschleichen von i.v.-/epidural-PCA |
| Morphin (Sevredol) | Mässige bis starke Schmerzen | Einzeldosis 10mg | 1-3 h | Kurzwirksam 1-3 h | Zur Dosisfindung zusammen mit MST Bei Schmerzspitzen |
| Ondansetron (Zofran) |
Übelkeit / Erbrechen | 2x4mg/24 h i.v. | 15-30 min | 6-12 h | Sehr potent |
| Metamizol (Novalgin) |
Mässige bis starke Schmerzen | 3-4x 1g/d i.v. 4x 20-40 Trpf/d p.o. |
30-60 min | 4-6 h | Kann Blutzellbildungsstörungen verursachen, Allergien, Anaphylaktische Reaktion möglich |
| Oxycodon (Oxycontin) |
Starke Schmerzen | Ab 2x 5mg/d p.o. | 1-3 h | 6-12 h Langwirksam |
Achtung Überdosierung: Sedation, Atemdepression, NW: Nausea, Juckreiz Tabletten nicht teilen !!! |
| Oxycodon (Oxynorm) |
Starke Schmerzen | In Reserve 5mg = 0.5ml p.o. | 30-60 min | 1-3 h Kurzwirksam |
Reservemedikation zu Oxycontin |
| Tramadol (Tramundin, Tramal) |
Mässige Schmerzen | Variabel (kurz- und langwirksam als Tbl.) Tropfen kurzwirksam |
1-2 h | 6-12 h Langwirksam 1-2 h Kurzwirksam |
Häufig Übelkeit und Schwindel Schwaches Opiat |
| Diclofenac (Olfen/Voltaren) |
Leichte bis mässige Schmerzen | 150mg/d p.o. in 2-3 Dosen 2x 75mg i.v. |
1-2 h p.o. 30-60 min i.v. |
6-8 h | COX-1-selektives NSAR Nicht bei Niereninsuffizienz und Magenblutung (zusätzlich Magenschutz) |
Frequently asked questions (FAQ)
Frage: Soll Olfen (Diclofenac) 3x50mg folglich nicht mehr verordnet werden?
Antwort: So die Medikamentengabe so organisiert wird, dass v.a. die Abenddosis erst um ca 20 Uhr abgegeben wird, kann auch 3x50mg abgegeben werden. Ansonsten empfehlen wir Voltaren 2x75mg
Frage: Darf eine IV-PCA von der Pflege angefordert werden?
Antwort: Die Verordnung einer PCA wird wird durch einen Arzt abgegeben. Entweder kann Rücksprache mit dem Sucher Schmerztherapie (1510) genommen werden, ein Schmerzkonsil angemeldet werden oder auf entsprechende Anordnung der Schmerztherapie direkt mit dem Aufwachraum Rücksprache genommen werden.
Frage: Soll ein DK bei einem Patienten mit einem Epidural-Katheter (epiudral PCA) möglichst früh gezogen werden?
Antwort: Ja soll er, aber nur wenn er thorakal bei thoraxchirurgischen Operationen eingelegt wurde unter initialer Miktionskontrolle zur Vermeidung einer Harnretention/Überlaufblase. Bei viszeralchirugischen Eingriffen und liegendem epiduralem Katheter soll der Katheter je nach Ausbreitung nur und ausschliesslich nach Rücksprache mit dem zuständigen Arzt der Schmerztherapie entfernt werden. (Siehe dazu auch Kapitel Pflegerische Verrichtungen)
Frage: Sollen gemäss neuem Schmerzkonzept keine Opiate mehr subcutan
verabreicht werden?
Antwort: Grundsätzlich wird die Gabe von Opiaten über die pharmakokinetisch klaren Routen bevorzugt. Die perorale Gabe wie auch die intravenöse Applikation sind dabei deutlich klarer und sicherer steuerbar als die repetitive subkutane Applikation. Die überaus meisten Fälle von Atemdepressionen traten auf bei repetitiven Subkutangaben in Kombination mit Benzodiazepinen! Wir empfehlen, je nach zu erwartenden Schmerzen zu verordnen: Bei Annahme, dass kaum Opiate gebraucht werden Morphin 5-10mg per os in Tropfenform oder alternativ 5-10mg subcutan. Bei Annahme von wiederholten Opiatgaben primär IV-PCA erwägen oder auf eine retardierte Basis zurückgreifen (Oxycontin oder MST) sowie das dazugehörige kurzwirksame Präparat (Oxynormtropfen oder -kapseln oder Morphintropfen)
Frage: Ist gemäss neuem Schmerzkonzept die Gabe von Pethidin nun verboten?
Antwort: Verboten keineswegs, doch mit Vehemenz nicht mehr empfohlen. Das Nebenwirkungspotential kombiniert mit der schwachen Wirkung rechtfertigen den Einsatz dieses Medikamentes nicht mehr. Möglicherweise wird es in Bälde aus der Spitalarzneimittelliste verschwinden.